Actualizado 30 junio, 2021
Según la física, la materia es todo aquello que ocupa un lugar en el espacio que posee volumen y masa, ya sea una entidad, un campo o una discontinuidad, esta viaja mediante el espacio- tiempo a una similar o menor velocidad que la luz, vivimos rodeados de materia, el aire, las plantas, la comida, nuestras casas, e incluso nosotros mismos. Básicamente es lo que conforma a cada cosa física, esta se clasifica según sus propiedades, también la podemos clasificar según el estado en el que se encuentre y finalmente la clasificación según las formas en las que podemos encontrar a la materia, sustancias puras y mezclas.
Propiedades de la materia
Las propiedades de la materia son las características de la misma y se dividen en dos: específicas y generales.
Propiedades generales de la materia
Las características generales de la materia son aquellas que se pueden percibir con los cinco sentidos: el tacto, la vista, el olfato, la audición y el sabor.
– volumen
- Se refiere al espacio que ocupa la materia, es una magnitud métrica que deriva de la longitud, es la amplitud del cuerpo según las tres dimensiones: alto, ancho y largo. Haciendo la multiplicación entre la altura y el ancho obtenemos el volumen del cuerpo.
– masa
- Representa a la cantidad de materia dentro de un cuerpo o un objeto, la masa es algo que posee todo objeto sin importar el estado en el que esté. Es una magnitud física escalar la cual se expresa internacionalmente mediante kilogramos (Kg).
– peso
- Es la medición de la fuerza de la gravedad sobre un objeto, se iguala a la fuerza que produce un cuerpo sobre un punto de soporte, el peso es una fuerza y por lo tanto se expresa mediante Newtons. Se puede calcular como la masa del objeto multiplicada por la aceleración de la gravedad (p= m . g)
– inercia
- Es un estado que poseen ciertos cuerpos de materia, cuando tienen cierta resistencia a modificar el estado de movimiento, así permanecer en un estado de reposo relativo o en términos de física, mantiene un estado de MRU o movimiento rectilíneo uniforme. En cuanto a la inercia en el ámbito de la química, esta se refiere a los elementos que no reaccionan químicamente en presencia de elementos de otros grupos químicos.
– divisibilidad
- El concepto de divisibilidad es utilizado en las matemáticas, pero también se utiliza en otros ámbitos como lo es la química, ya que esta realiza un estudio de la materia en la cual hay cierta división. La materia siento una sustancia tiene la capacidad de dividirse o separarse en moléculas, las cuales se dividen en átomos y estos en neutrones, protones y electrones.
– porosidad
- Cuando mencionamos a a porosidad de la materia nos referimos a la capacidad que tiene esta para absorber sustancias que se encuentren en estado líquido o gaseoso a través de «huecos», entonces básicamente podríamos decir que la porosidad es el volumen que posee un sólido hueco, la cual permite la interacción con otras sustancias.
– impenetrabilidad
- La impenetrabilidad de la materia es el contrario a la porosidad, ya que esta impide que otro cuerpo traspase u ocupe su espacio, al tener masa es imposible que una sustancia penetre en la materia.
Propiedades específicas de la materia
Las propiedades específicas de la materia son las que diferencian a cada objeto, se dividen en dos grandes grupos: las físicas y las químicas.
– Propiedades específicas físicas
Estas son las que determinan la forma y el estado en el que se encuentra la materia, estos son:
- Elasticidad: cuando la materia tiene la capacidad de deformarse y volver a su forma natural.
- Punto de ebullición: cuando el punto de temperatura es muy alto, los líquidos llegan a un punto en el que el nivel de la presión del vapor es alto lo cual provoca burbujas grandes.
- Punto de fusión: es la temperatura a la que una materia en estado sólido pasa a ser líquido, este se determina según la presión. Cuando es inverso se denomina punto de cristalización .
- Brillo: es la reflexión de la luz en un mineral, depende de cuánta luz se refleje y se absorba.
- Densidad: es una magnitud escalar que determina la cantidad de masa que se encuentra en determinado volumen de la materia, su ecuación es la división de la masa entre el volumen.
- Conductividad térmica: cuando decimos que un material conduce la temperatura nos referimos a la capacidad de la materia para transportar la temperatura, por ejemplo, la madera no conduce el calor y es por eso que si dejamos a una cuchara de madera en una olla caliente la cuchara no se calienta, a diferencia del metal que se considera buen conductor de calor.
- Conductividad eléctrica: esta es la manera en la que un material conduce a la electricidad de un cuerpo a otro, los mejores conductores de electricidad son los metales como el hierro, el oro, entre otros.
- Dureza: es una propiedad que poseen los materiales que define la dificultad para marcarlo o rayarlo, es decir la resistencia a ser alterados. Algunos materiales con mayor dureza son el plomo, el bronce, la piedra, entre otros.
– Propiedades específicas químicas
Estas son las que determinan la reactividad del cuerpo cuando se convierte en otro, son las siguientes:
- Acidez: es una capacidad que poseen ciertas sustancias la cual se puede determinar a través de la escala de pH, el termino de acidez se acompaña con la alcalinidad.
- Alcalinidad: la alcalinidad o basicidad permite determinar si un material es base o ácido, es la capacidad que tiene una materia para fluctuar la cantidad de protones libres, se puede medir por escala de pH la cual va del 0 al 14, una sustancia ácida es de 7 o menor, en cambio una base es mayor a 7.
- Reactividad: la reactividad de la materia es la forma en la que reacciona a un cambio con otros elementos químicos y así transformarse en otro producto diferente, como por ejemplo la fotosíntesis o cuando hacemos la digestión.
- Combustibilidad: es la facilidad con la que se incendia un material, el punto de inflamabilidad, algunas sustancias inflamables son el alcohol etílico, la gasolina, el queroseno, entre otras.
Estados de la materia
La materia se puede encontrar en tres estados o también llamados formas de agregación: sólido, líquido y gaseoso. Hay un solo caso en el que la materia se puede encontrar de manera natural en los tres estados, es el agua.
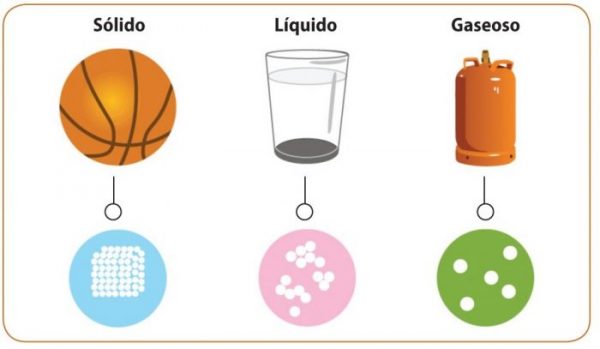
Sólido
– Los cuerpos que se encuentran en estado sólido mantienen una forma y volumen constantes, ya que las partículas que componen a la materia tienen gran fuerza de atracción, estas partículas tienen la capacidad de vibrar pero no de trasladarse, cuanta más temperatura haya las partículas vibran aún más.
– ejemplos:
- sal
- azúcar
- madera
- caolín
- piedra
- metal
- plástico
- ámbar
- vidrio
- yeso
- perla
- diamante
- arena
- hierro
- obsidiana
- papel
- carbón
- cuarzo
- hielo
- silicio
Líquido
– Cuando la materia esta en estado líquido tiene un volumen constante pero no mantiene una forma específica ya que toma la forma del envase o de la superficie en la que se encuentre. Las partículas que conforman al líquido tienen baja fuerza de atracción y es por esto que tienen mucha libertad al trasladarse, además por unidad de volumen hay una gran cantidad de partículas y esto causa que generen fricción y colisiones entre ellas. Cuando la temperatura aumenta, aumenta la energía de las partículas y se mueven más.
– ejemplos:
- agua
- saliva
- mercurio
- alcohol etílico
- aceite
- metanol
- vinagre
- ácido sulfúrico
- leche
- metales fundidos
- ácido fosfórico
- petróleo
- tolueno
- formol
- acetona
- cloroformo
- jugo de fruta
- líquido cefalorraquídeo
- glicerina
- ácido clorhídrico
Gaseoso
– Cuando la materia se encuentra en estado gaseoso pierde su volumen y su forma fija, ya que por unidad de volumen hay pocas partículas con mucha libertad de movilidad y se expanden rápidamente ocupando todo el espacio, cuando el espacio es muy reducido, el gas pasa a ser un líquido debido a que tiene cierto límite de comprensibilidad. Si la temperatura se eleva las partículas se mueven de manera más rápida y chocan en las paredes del envase o espacio en el que se encuentra y la presión se eleva.

– ejemplos:
- oxígeno
- hidrógeno
- ozono
- propano
- aire
- vapor de agua
- monóxido de carbono
- hidróxido de carbono
- metano
- helio
- amoníaco
- gas sulfhídrico
- propano
- flúor
- neón
- acetileno
- gas natural
- nitrógeno en gas
- xenón
- acetileno
agua

– Previamente mencionamos que la única materia que se encuentra naturalmente en los tres estados de agregación es el agua, cuando la temperatura es intermedia esta se encuentra en estado líquido, cuando la temperatura es muy baja como en un congelador esta se convierte en hielo que sería estado sólido, y por último cuando la temperatura es muy alta como cuando nos bañamos, esta se convierte en estado gaseoso que es lo que llamamos vapor.
Clasificación de la materia
La materia tiene una clasificación que permite dividir a las sustancias puras y las mezclas, ya que son dos cuerpos de materia que podemos encontrar en la naturaleza y son completamente diferentes.
Sustancias puras
Las sustancias puras son aquellas que el estado de agregación en el que se encuentre no altera la composición ni su naturaleza, y tampoco pueden ser divididas en otras sustancias, estas se dividen en dos grupos, los elementos y los compuestos
– elementos
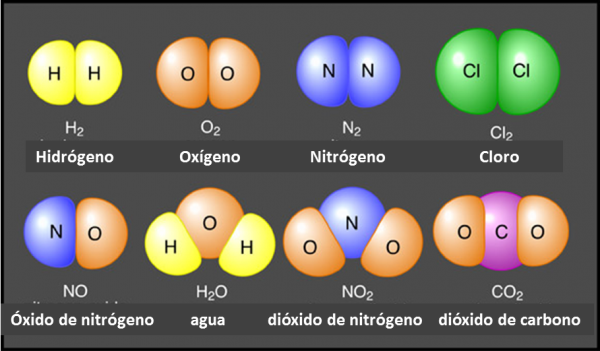
También llamadas sustancias simples, estas no pueden ser simplificadas ya que están compuestas por una única clase de átomos. En la actualidad hay 118 elementos los cuales podemos encontrar en la tabla periódica de los elementos muy utilizada en química, se sabe que una gran parte del cuerpo humano está compuesto por tres elementos principales, que son el oxígeno, el hidrógeno y el carbono. Hay muchos elementos químicos que son bastante conocidos, como los tres mencionados previamente, el calcio, el nitrógeno, sodio, hierro, entre otros.

– compuestos
Por lo contrario, los compuestos como lo indica su nombre, están compuestos por dos o más clases de átomos pero aún así no pueden ser divididas mediante procesos físicos, sí pueden ser simplificados en sustancias más simples pero por reacciones químicas. Estos compuestos son uniones de los elementos, por ejemplo el H2O (agua destilada) que esta compuesto por dos moléculas de hidrogeno y una de oxigeno, o también la sal que es NaCl, compuesta por una molécula de sodio y una de cloro.
Mezclas
Las mezclas son uniones de dos o más sustancias puras, estas sustancias mantienen sus identidades químicas más allá de que se mezclen con otras diferentes, estas se dividen en dos grupos, homogéneas y heterogéneas
– mezclas homogéneas
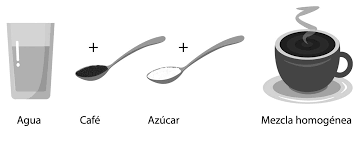
También conocidas como disoluciones, estas son mezclas que no es posible distinguir sus elementos a simple vista ya que es tiene una sola fase, esto quiere decir que es materia con una composición uniforme. Las mezclas homogéneas consisten en dos partes, un soluto y un solvente, este último generalmente se encuentra en mayor cantidad y suele ser un líquido, mientras que el soluto puede ser más de uno y se puede encontrar en los tres estados, ya sea sólido, líquido o gaseoso. Por ejemplo: una dilución de sal o azúcar en agua, el agua seria el solvente y el soluto seria la sal o el azúcar. Los componentes de este tipo de mezclas pueden ser separados mediante los siguientes métodos:
destilación:
Es el método más utilizado para separar las mezclas homogéneas, y hay dos tipos, la destilación simple y destilación fraccionada, este método se basa en la ebullición y post condensación de las sustancias, cuando estos difieren en los puntos de ebullición.
cristalización:
Consiste en formar un sólido (cristal), mediante el calentamiento de la sustancia y se deja en reposo mientras que baje su temperatura, aquí uno de sus componentes va a cristalizarse de a poco y formar una mezcla heterogénea.
evaporación:
Generalmente se realiza con mezclas en que se ha disuelto un solo soluto, por ejemplo azúcar y agua, se coloca en un recipiente de boca ancha y se calienta, el solvente se evapora y queda como resultado el soluto.
cromatografía:
Este método, a diferencia los explicados previamente, sirve solo para procesar a una pequeña parte de la mezcla, pero es capaz de clasificar a los elementos de los que la mezcla estaba compuesta, hay varios tipos de cromatografía pero no son métodos comunes.
– mezclas heterogéneas
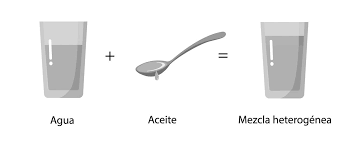
Al diferencia de las mezclas homogéneas, las heterogéneas tienen dos o más fases, es decir que no son uniformes y por ello los componentes se pueden diferenciar a simple vista, en estas cada componente mantiene su identidad química. Algunos ejemplos de mezclas heterogéneas son agua con aceite, agua con arena, la piedra de granito, entre otros. Al igual que las mezclas homogéneas, estas se pueden separar de varias formas:
decantación
Un ejemplo muy visible de mezclas heterogéneas es del del agua y aceite, este método sirve para casos líquido-líquido como este que tratan de dos líquidos no miscibles entre ellos, y también para mezclas de sólido-líquido que sería un sólido insoluble en el líquido, el método de decantación líquido-líquido consiste en colocar la mezcla en un embudo de decantación y dejar reposar por determinado tiempo, y según la densidad del líquido uno quedara dentro del embudo. Mientras que en una mezcla sólido-líquido se deja reposar en un recipiente y con el tiempo el sólido quedara separado en el fondo del recipiente.
magnetismo
En este caso, el mismo nombre nos indica de lo que trata, cuando hay mezclas heterogéneas con componentes magnéticos se utiliza un imán y al acercarlo a la mezcla el material magnético se separará de la mezcla uniéndose al imán.
filtración
En casos de mezclas heterogéneas de sólido-líquido la filtración es el método más utilizado, por ejemplo el agua con arena, se utiliza un recipiente y un papel, el papel cumple la función de retener al sólido y dejar pasar el líquido, quedaría la arena en el papel y por otra parte el agua en el recipiente.
tamizado
Este método también es muy utilizado en la cocina, consiste en separar una mezcla heterogénea de sólido-sólido pero que varía en su tamaño, se utiliza un tamizador o colador y se pasa la mezcla, al final queda la parte más fina en el recipiente y los restos más grandes en el colador.
centrifugación
Para separar una mezcla compuesta de elementos que varían en densidad se puede utilizar la centrifugación, que consta en utilizar un aparato llamado centrifugadora la cual mediante constantes movimientos separa a las partículas de mayor densidad de las de menor densidad.